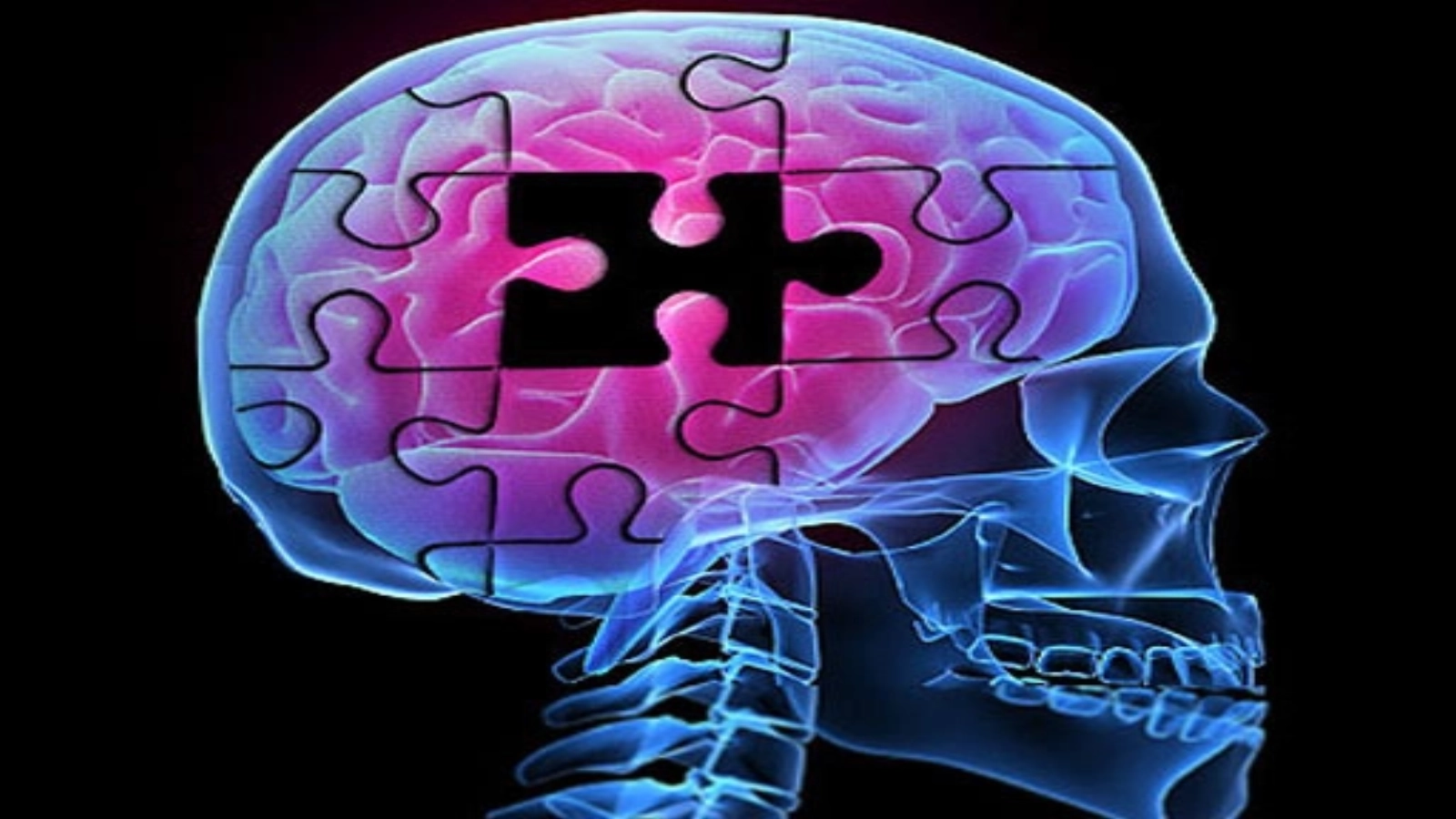
Agenţia pentru Alimente şi Medicamente (Food and Drug Administration - FDA) din Statele Unite a aprobat medicamentul Aducanumab, dezvoltat de compania Biogen, ca prim tratament al uneia dintre cauzele de bază ale maladiei Alzheimer, în pofida controverselor legate de rezultatele neconcludente ale testelor sale clinice, informează Reuters.
Aducanumab vizează eliminarea depozitelor aderente ale unei proteine denumite beta-amiloid din creierele pacienţilor aflaţi în primele stadii ale maladiei Alzheimer, cu scopul de a opri ravagiile provocate de această boală, printre care se află pierderea memoriei şi a capacităţii de a avea grijă de propria persoană, scrie Agerpres.ro.
FDA a anunţat că testele clinice dedicate acestui tratament, care va fi comercializat sub numele oficial Aduhelm, au arătat o reducere a plăcilor amiloide, care ar trebui să ducă la scăderea declinului cognitiv al pacienţilor.
"Deşi datele despre Aduhelm sunt complicate şi din respect faţă de beneficiile sale clinice, FDA a stabilit că există dovezi substanţiale care arată că Aduhelm reduce plăcile de beta-amiloid din creier şi că este rezonabil să credem că reducerea acestor plăci va duce cel mai probabil la beneficii importante pentru pacienţi", a precizat agenţia americană într-un comunicat.
Medicamentul dezvoltat de compania Biogen a fost lăudat de susţinătorii pacienţilor cu Alzheimer şi de unii neurologi care aşteaptă cu nerăbdare să dispună de o opţiune eficientă pentru pacienţii lor diagnosticaţi cu această maladie mortală. Alţi medici afirmă însă că rezultatele studiilor clinice sunt neconcludente şi că este nevoie de mai multe dovezi medicale.
FDA precizează că Biogen trebuie să organizeze şi un studiu clinic post-autorizare pentru a verifica beneficiile clinice ale medicamentului.
"Dacă medicamentul nu funcţionează aşa cum sperăm, vom putea să luăm măsuri pentru a îl retrage de pe piaţă", a precizat FDA.
Aducanumab a fost studiat pe pacienţi cu stadii incipiente ale bolii, care au fost testaţi pozitiv la o componentă din structura plăcilor amiloide din creier. Unii dintre participanţii la studiu au experimentat inflamaţii cerebrale potenţial periculoase.
Biogen estimează că aproximativ 1,5 milioane de americani sunt eligibili pentru tratamentul cu Aducanumab, care este administrat printr-o perfuzie lunară, fapt care stârneşte îngrijorări legate de costurile generate asupra sistemului de sănătate din Statele Unite.



























Comentează