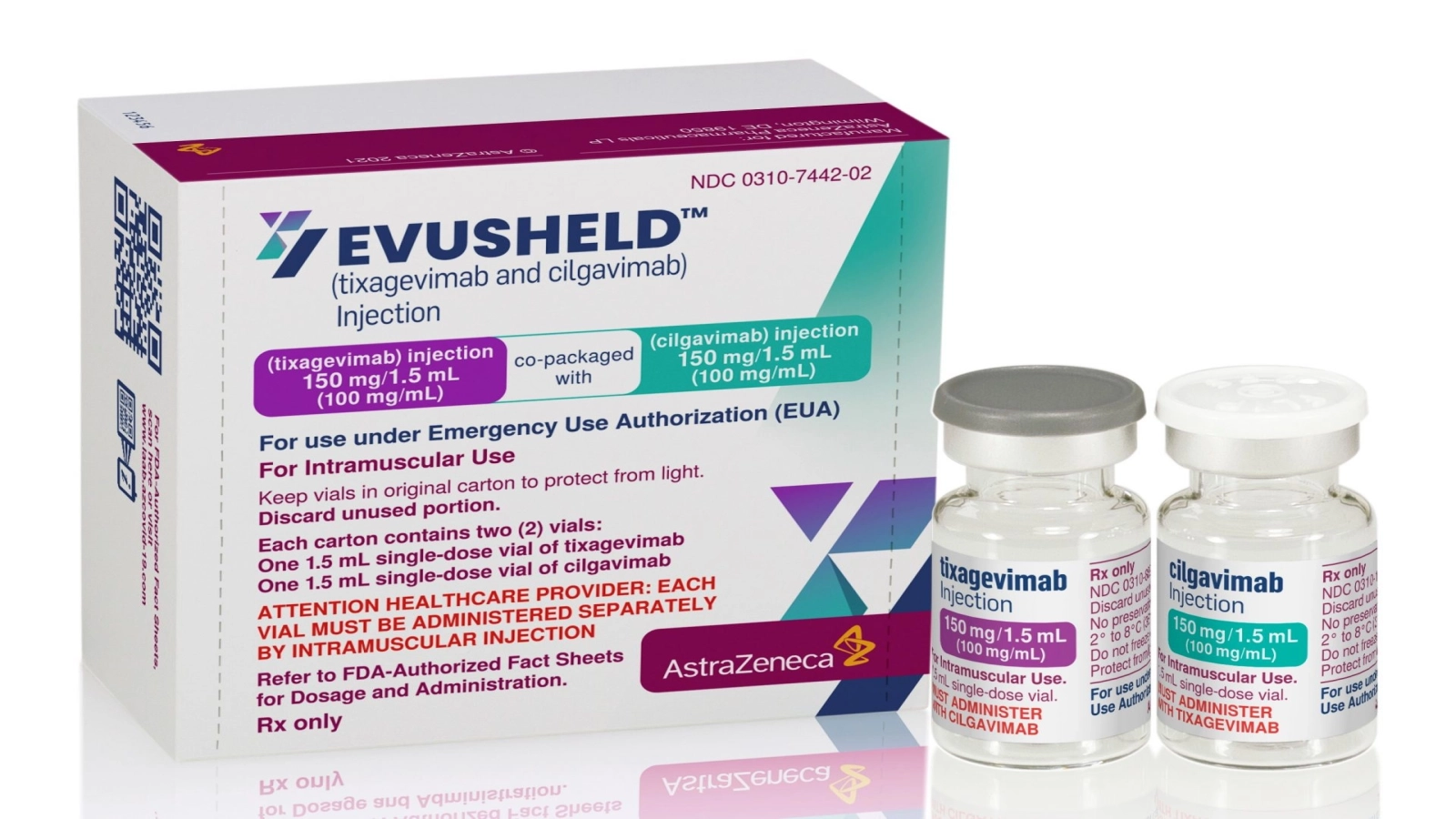
Evusheld (tixagevimab co-ambalat cu cilgavimab) al companiei AstraZeneca, o combinație de anticorpi monoclonali cu acțiune prelungită, a primit autorizare de punere pe piață în Uniunea Europeană (UE) pentru profilaxia pre-expunere a COVID-19 la o populație largă de adulți și adolescenți cu vârsta de peste 12 ani, cu greutate de cel puțin 40 kg. Anunțul complet al companiei este disponibil aici:
Comisia Europeană si-a bazat aprobarea pe analiza datelor Evusheld, care include rezultatele studiului de fază III de profilaxie pre-expunere PROVENT, ce a arătat la analiza primară o reducere cu 77% a riscului de dezvoltare a unei forme simptomatice de COVID-19, în comparație cu placebo și o reducere de 83% la o analiză intermediara la șase luni, protecția împotriva virusului fiind menținuta timp de cel puțin șase luni.1-3 Evusheld a fost în general bine tolerat în studiu. 1-3
Radu Rășinar, director general AstraZeneca România a menționat: „există categorii de pacienți care au nevoie de protecție suplimentară, iar medicii specialiști sunt cei care au claritate asupra gradului de risc atât din perspectiva afecțiunii de bază, cât și a tratamentului de fond și a expunerii; lucrăm împreună cu autoritățile, pentru a identifica mecanismul cel mai bun de a asigura această soluție pentru pacienții din Romania. Vulnerabilitatea cea mai mare a fost identificată la pacienții cu transplant, sau aflați pe lista de așteptare, pacienții cu afecțiuni hemato-oncologice (mielom multiplu, leucemii cronice), afecțiuni oncologice, boli inflamatorii ce necesită terapie imunosupresoare.”
„Pacientul care va începe un tratament oncologic va fi un pacient imunosupresat datorită tratamentului oncologic în sine. Pacientul oncologic în tratament activ sau pacienții cu potențiale urgențe oncologice, cei cu radio-chimioterapie pot beneficia de acest tratament pre expunere pentru profilaxia COVID-19 cu anticorpi monoclonali cu durată lungă de acțiune.” a afirmat Prof. Asociat Dr. Dana Lucia Stănculeanu, Universitatea de Medicină și Farmacie „Carol Davila”, București.
Există un număr tot mai mare de dovezi din mai multe studii independente in vitro și in vivo (model animal) care susțin potențialul Evusheld de a proteja împotriva subvariantelor BA.1, BA.1.1 și BA.2 Omicron SARS-CoV-2, aflate astăzi în circulație la nivel global. 4
Evusheld este autorizat pentru utilizare de urgență pentru profilaxia pre-expunere a COVID 19 în SUA și a primit autorizație de introducere pe piață condiționată de către Agenția de Reglementare a Medicamentului și a Produselor de Sănătate (MHRA) din Marea Britanie pentru profilaxia pre-expunere a COVID-19. În plus, există o serie de țări din Europa care au în vigoare acorduri pentru a furniza Evusheld.
AstraZeneca este o companie biofarmaceutică globală bazată pe știință, centrată pe descoperirea dezvoltarea și comercializarea de medicamente inovatoare care sunt eliberate pe bază de prescripție medicală în oncologie, boli rare, precum și în bolile cardiovasculare, renale și metabolice, în patologiile respiratorii și imunologie. Cu sediul în Cambridge, Marea Britanie, AstraZeneca opereazăîn peste 100 de țări iar medicamentele sale inovative sunt utilizate de milioane de pacienți în toată lumea. Vă rugăm să vizitați www.astrazeneca.com pentru mai multe detalii.
Referințe
US Food and Drug Administration. FACT SHEET FOR HEALTHCARE PROVIDERS: EMERGENCY USE AUTHORIZATION FOR EVUSHELDTM (tixagevimab co-packaged with cilgavimab). Disponibil la: https://www.fda.gov/media/154701/download [Accesat: martie 2022].
AstraZeneca – comunicat de presă. AZD7442 PROVENT Phase III prophylaxis trial met primary endpoint in preventing COVID-19. Disponibil la: https://www.astrazeneca.com/media centre/press-releases/2021/azd7442-prophylaxis-trial-met-primary-endpoint.html [Accesat: martie 2022].
AstraZeneca – comunicat de presă. New analyses of two AZD7442 COVID-19 trials in high-risk populations confirm robust efficacy and long-term prevention. Disponibil la:
https://www.astrazeneca.com/media-centre/press-releases/2021/new-analyses-of-two-azd7442- covid-19-phase-iii-trials-in-high-risk-populations-confirm-robust-efficacy-and-long-term prevention.html. [Accesat: martie 2022]
Case, J et al. Resilience of S309 and AZD7442 monoclonal antibody treatments against infection by SARS-CoV-2 Omicron lineage strains Disponibil
la: https://www.biorxiv.org/content/10.1101/2022.03.17.484787v1 [Accesat: martie 2022]. RO – 11223 / 03.2022

















Comentează